   |
|
| Sistematic Nume | benzen |
| Abrevieri | PhH |
| Nume tradiționale | uscător de păr (Laurent, 1837), fenil hidrogen, benzen |
| Chim. formulă | C₆H₆ |
| Stat | lichid |
| Masă molară | 78,11 g/mol |
| Densitate | 0,8786 g/cm³ |
| Vascozitate dinamica | 0,0652 Pa s |
| Energie de ionizare | 9,24 ± 0,01 eV |
| T. se topesc. | 5,5° |
| T. kip. | 80,1° |
| T. rev. | −11° |
| T. svsp. | 562° |
| etc. explozie | 1,2 ± 0,1% vol. |
| Presiunea aburului | 75 ± 1 mmHg |
| Solubilitate in apa | 0,073 g/100 ml |
| GOST | GOST 5955-75 |
| Reg. numar CAS | 71-43-2 |
| PubChem | 241 |
| Reg. numărul EINECS | 200-753-7 |
| ZÂMBETE | C1=CC=CC=C1 |
| InChI | |
| RTECS | CY1400000 |
| CHEBI | 16716 |
| ChemSpider | 236 |
| Toxicitate | toxic, are proprietăți cancerigene și narcotice |
| cuvant de semnal | PERICULOS! |
| Datele sunt furnizate pentru conditii standard(25°, 100 kPa) dacă nu este specificat altfel. | |
Proprietăți chimice
Reacțiile de substituție sunt caracteristice benzenului - benzenul reacționează cu alchene, cloroalcani, halogeni, acizi azotic și sulfuric. Reacțiile de scindare a inelului benzen au loc în condiții dure (temperatură, presiune).
- Interacțiunea cu alchenele (alchilare), ca rezultat al reacției, se formează omologi de benzen, de exemplu, etilbenzen și cumen:
- Interacțiunea cu clorul și bromul în prezența unui catalizator pentru a forma clorobenzen (reacție de substituție electrofilă):
- În absența unui catalizator, atunci când este încălzit sau iluminat, are loc o reacție de adiție radicală cu formarea unui amestec de izomeri hexaclorociclohexan.
- Când benzenul reacționează cu bromul într-o soluție de oleum, se formează hexabromobenzen:
- Interacțiunea cu derivații de halogen ai alcanilor (alchilarea benzenului, reacția Friedel-Crafts) pentru a forma alchilbenzeni:

- Reacția de acilare Friedel-Crafts a anhidridelor de benzen, halogenurilor de acid carboxilic duce la formarea de cetone aromatice și aromatice grase:

6 6 + 6 5 COCl → AlCl 3 6 5 COC 6 5 + HCl
În prima și a doua reacție, se formează acetofenona (metilfenilcetonă), înlocuirea clorurii de aluminiu cu clorură de antimoniu permite ca temperatura reacției să fie redusă la 25 ° C. În a treia reacție se formează benzofenonă (difenilcetonă).
- Reacția de formilare - interacțiunea benzenului cu un amestec de CO și HCl, are loc la presiune ridicata iar sub acțiunea unui catalizator, produsul de reacție este benzaldehida:
- Reacții de sulfonare și nitrare (substituție electrofilă):
- Reducerea benzenului cu hidrogen (hidrogenare catalitică):
Reacții de oxidare
Benzenul, datorită structurii sale, este foarte rezistent la oxidare, nu este afectat, de exemplu, de o soluție de permanganat de potasiu. Cu toate acestea, oxidarea la anhidridă maleică poate fi efectuată folosind un catalizator de oxid de vanadiu:

- reacție de ozonoliză. De asemenea, benzenul suferă ozonoliză, dar procesul este mai lent decât în cazul hidrocarburilor nesaturate:

Rezultatul reacției este formarea de dialdehidă - glioxal (1,2-etanial).
- reacție de ardere. Arderea benzenului este cazul limitativ de oxidare. Benzenul este foarte inflamabil și arde în aer cu o flacără foarte fumurie:
Structura
Prin compoziție, benzenul aparține hidrocarburilor nesaturate (serie omologă n 2n−6), dar spre deosebire de hidrocarburile din seria etilenei, 2 4 , prezintă proprietăți inerente hidrocarburilor nesaturate (se caracterizează prin reacții de adiție), doar în condiții dure, dar benzenul este mai predispus la reacții de substituție. Acest „comportament” al benzenului se explică prin structura sa specială: prezența atomilor în același plan și prezența unui nor de electroni 6π conjugați în structură. Ideea modernă a naturii electronice a legăturilor din benzen se bazează pe ipoteza lui Linus Pauling, care a propus să descrie molecula de benzen ca un hexagon cu un cerc înscris, subliniind astfel absența legăturilor duble fixe și prezența unui nor de electroni care acoperă toți cei șase atomi de carbon ai ciclului.
În literatura de specialitate și populară, termenul inel de benzen, referindu-se, de regulă, la structura carbonică a benzenului fără a lua în considerare alți atomi și grupări asociate atomilor de carbon. Inelul benzenic face parte din mulți compuși diferiți.
Productie
Astăzi, există mai multe fundamentale diferite căi producția de benzen.

Aplicație

Transportul benzenului pe calea ferată se realizează în vagoane cisternă specializate
O parte semnificativă a benzenului rezultat este utilizată pentru sinteza altor produse:
- aproximativ 50% din benzen este transformat în etilbenzen (alchilarea benzenului cu etilenă);
- aproximativ 25% din benzen este transformat în cumen (alchilarea benzenului cu propilenă);
- aproximativ 10-15% din benzen este hidrogenat la ciclohexan;
- aproximativ 10% din benzen este cheltuit pentru producerea de nitrobenzen;
- 2-3% din benzen este transformat în alchilbenzeni lineari;
- aproximativ 1% din benzen este folosit pentru sinteza clorbenzenului.
În cantități mult mai mici, benzenul este utilizat pentru sinteza altor compuși. Ocazional și în cazuri extreme, datorită toxicității sale mari, benzenul este folosit ca solvent.
În plus, benzenul face parte din benzină. În anii 1920 și 1930, benzenul a fost adăugat ru de la benzina de exploatare directă pentru a-și crește ratingul octanic, dar până în anii 1940 astfel de amestecuri nu puteau concura cu benzinele cu octan ridicat. Datorită toxicității ridicate, conținutul de benzen în combustibil este limitat de standardele moderne la introducerea de până la 1%.
Acțiune biologică și toxicologie
Benzenul este unul dintre cele mai comune xenobiotice antropice.
Benzenul este foarte toxic. Doza minimă letală pentru administrare orală este de 15 ml, media este de 50-70 ml. Cu o inhalare scurtă de vapori de benzen, nu are loc o otrăvire imediată, prin urmare, până de curând, procedura de lucru cu benzen nu a fost reglementată în mod special. În doze mari, benzenul provoacă greață și amețeli, iar în unele cazuri severe, otrăvirea poate fi fatală. Primul semn al intoxicației cu benzen este adesea euforia. Vaporii de benzen pot pătrunde în pielea intactă. Benzenul lichid este destul de iritant pentru piele. În cazul în care corpul uman este expus unei expuneri pe termen lung la benzen în cantități mici, consecințele pot fi și foarte grave.
Benzenul este un cancerigen puternic. Studiile arată asocierea benzenului cu boli precum anemia aplastică, leucemia acută (mieloidă, limfoblastică), leucemia mieloidă cronică, sindromul mielodisplazic și bolile măduvei osoase.
Mecanismul de transformare și efectul mutagen al benzenului
Există mai multe variante ale mecanismului de transformare a benzenului în corpul uman. În prima variantă, molecula de benzen este hidroxilată de sistemul de oxidare microzomală cu participarea citocromului P450. Conform mecanismului, benzenul este mai întâi oxidat la un epoxid foarte reactiv, care este ulterior transformat în fenol. În plus, radicalii liberi (specii reactive de oxigen) sunt generați datorită activării ridicate a P450 conform reacției:
Mecanismul molecular al mutagenezei benzenului
Benzenul este promutagen, dobândește proprietăți mutagene numai după biotransformare, în urma căreia se formează compuși foarte reactivi. Unul dintre acestea este epoxidul de benzen. Datorită stresului unghiular mare al ciclului epoxidic, legăturile -C-O-C- se rupe și molecula devine electrofilă, reacționând ușor cu centrii nucleofili ai bazelor azotate ale moleculelor de acid nucleic, în special ADN.
Mecanismul de interacțiune a ciclului epoxidic cu centrii nucleofili - grupele amino ale bazelor azotate (reacție de arilare) decurge ca reacție substituție nucleofilă 2 . Ca urmare, se formează aducti ADN legați covalent destul de puternici, cel mai adesea astfel de derivați sunt observați în guanină (deoarece molecula de guanină are numărul maxim de centri nucleofili), de exemplu, N7-fenilguanina. Aductii ADN rezultați pot duce la o modificare a structurii native a ADN-ului, perturbând astfel cursul adecvat al transcripției și replicării. Care este sursa mutațiilor genetice. Acumularea de epoxid în hepatocite (celule hepatice) duce la consecințe ireversibile: o creștere a arilației ADN-ului și, în același timp, o creștere a expresiei (supraexpresiei) proteinelor mutante care sunt produse ale unei mutații genetice; inhibarea apoptozei; transformarea celulară și chiar moartea. Pe lângă genotoxicitatea și mutagenitatea pronunțate, benzenul are o puternică mielotoxicitate și activitate carcinogenă, în special acest efect se manifestă în celulele țesutului mieloid (celulele acestui țesut sunt foarte sensibile la acest tip de efecte xenobiotice).
Abuzul de benzen și substanțe
Benzenul are un efect uluitor asupra unei persoane și poate duce la dependența de droguri.
Intoxicatia acuta
La concentrații foarte mari - pierderea aproape instantanee a conștienței și moartea în câteva minute. Culoarea feței este cianotică, membranele mucoase sunt adesea roșu vișiniu. La concentrații mai mici - excitare, similară cu alcoolul, apoi somnolență, slăbiciune generală, amețeli, greață, vărsături, durere de cap, pierderea conștienței. Se observă, de asemenea, contracții musculare, care se pot transforma în convulsii tonice. Pupilele sunt adesea dilatate și nu răspund la lumină. Respirația este mai întâi accelerată, apoi încetinită. Temperatura corpului scade brusc. Puls accelerat, umplutură mică. Tensiunea arterială este scăzută. Au fost raportate cazuri de aritmii cardiace severe.
După otrăvire severă care nu duce direct la moarte, se observă uneori tulburări de sănătate pe termen lung: pleurezie, cataruri ale tractului respirator superior, boli ale corneei și retinei, leziuni hepatice, tulburări cardiace etc. Un caz de vasomotor nevroză cu umflarea feței și a extremităților, tulburări de sensibilitate și convulsii la scurt timp după intoxicația acută cu vapori de benzen. Uneori moartea are loc la ceva timp după otrăvire.
intoxicație cronică
În cazuri severe, există: dureri de cap, oboseală extremă, dificultăți de respirație, amețeli, slăbiciune, nervozitate, somnolență sau insomnie, indigestie, greață, uneori vărsături, lipsă de poftă de mâncare, urinare crescută, menstruație, sângerare persistentă din mucoasa bucală, în special gingiile, adesea se dezvoltă, și nasul, care durează ore și chiar zile. Uneori apar sângerări persistente după extracția dinților. Numeroase mici hemoragii (hemoragii) la nivelul pielii. Sânge în scaune, sângerare uterină, hemoragie retiniană. De obicei, sângerarea și, adesea, febra însoțitoare (temperatură de până la 40 ° și peste) este cea care aduce otrăvitul la spital. În astfel de cazuri, prognosticul este întotdeauna grav. Cauza morții sunt uneori infecții secundare: există cazuri de inflamație gangrenoasă a periostului și necroză a maxilarului, inflamație ulceroasă severă a gingiilor, sepsis general cu endometrită septică.
Uneori, intoxicațiile severe dezvoltă simptome boli nervoase: reflexe tendinoase crescute, clonus bilateral, simptom Babinsky pozitiv, tulburare de sensibilitate profundă, tulburări pseudotabetice cu parestezii, ataxie, paraplegie și tulburări motorii (semne de afectare a coloanelor posterioare ale măduvei spinării și tractului piramidal).
Cele mai tipice modificări în sânge. Numărul de eritrocite este de obicei redus brusc, până la 1-2 milioane și mai jos. Conținutul de hemoglobină scade, de asemenea, brusc, uneori până la 10%. Indicele de culoare în unele cazuri este scăzut, uneori aproape de normal și uneori ridicat (mai ales în cazul anemiei severe). Se remarcă anizocitoză și poikilocitoză, puncție bazofilă și apariția eritrocitelor nucleare, creșterea numărului de reticulocite și a volumului eritrocitelor. O scădere bruscă a numărului de leucocite este mai tipică. Uneori, inițial leucocitoză, înlocuită rapid de leucopenie, accelerarea VSH. Modificările în sânge nu se dezvoltă simultan. Cel mai adesea, sistemul leucopoietic este afectat mai devreme, mai târziu se alătură trombocitopenia. Înfrângerea funcției eritroblastice apare adesea și mai târziu. În viitor, se poate dezvolta o imagine caracteristică a otrăvirii severe - anemie aplastică.
Efectele otrăvirii pot persista și chiar progresa la luni și ani de la încetarea lucrului cu benzen.
Primul ajutor pentru otrăvire și tratament
În caz de otrăvire acută cu benzen (vapori de benzen), victima trebuie mai întâi scoasă la aer curat, în caz de stop respirator, respirația artificială se normalizează, oxigenul și lobelina sunt folosite ca stimulente respiratorii. Utilizarea adrenalinei ca analeptic este strict interzisă! Dacă apar vărsături, intravenos soluție de glucoză 40%, în caz de tulburări circulatorii - injectare soluție de cafeină. Dacă otrăvirea a avut loc pe cale orală și benzenul a intrat în stomac, este necesar să îl clătiți cu ulei vegetal(absoarbe bine benzenul), procedura trebuie efectuată cu prudență, deoarece aspirația este posibilă. Cu o otrăvire ușoară, pacientului i se arată odihnă. În stările excitate, sunt necesare sedative. În caz de anemie, se efectuează transfuzii de sânge, vitamina B12, acid folic, în caz de leucopenie - vitamina B6, pentoxil. În cazul scăderii imunității (starea de imunodeficiență) - imunostimulante.
Acțiunea benzenului asupra biomembranelor
Membranele biologice sunt structuri supramoleculare - un strat dublu lipidic în care moleculele de proteine și polizaharide sunt integrate (încorporate) sau atașate la suprafață. Lipidele care alcătuiesc biomembranele sunt prin natura lor compuși amfifili (amofili), adică capabili să se dizolve atât în substanțe polare, cât și nepolare, datorită prezenței grupărilor polare în ele, așa-numitele. "cap"(carboxilic -COOH, hidroxil -OH, grupări amino -NH 2 și altele) și așa-numitele nepolare. "cozi"(radicali hidrocarburi - alchili, arii, structuri policiclice precum colestanul și altele).
Benzenul este un solubilizator eficient al membranelor biologice, dizolvă rapid grupările nepolare (așa-numita hidrocarbură "cozi") lipide, în principal colesterol, care face parte din membrane. Procesul de solubilizare este limitat de concentrația de benzen, cu cât este mai mult, cu atât mai rapid se desfășoară acest proces. În procesul de solubilizare, se eliberează energie, rupând literalmente stratul dublu lipidic (dublu strat lipidic), ceea ce duce la distrugerea completă (distrugerea structurii) a membranei și la apoptoza celulară ulterioară (în timpul distrugerii biomembranelor, receptorii membranari sunt activați (cum ar fi precum: CD95, TNFR1, DR3, DR4 și altele) care activează apoptoza celulară).
Acțiune asupra pielii
La contactul frecvent al mâinilor cu benzen, se observă piele uscată, crăpături, mâncărime, roșeață (de obicei între degete), umflături, erupții cu bule asemănătoare meiului. Uneori, din cauza leziunilor cutanate, lucrătorii sunt nevoiți să renunțe la locul de muncă.
Concentrația maximă admisă este de 5 mg/m 3 .
Siguranță
Lucrul cu benzen implică riscul de otrăvire și probleme grave de sănătate. Benzenul este un lichid foarte volatil (volatilitate 320 mg/l la 20 ° C) cu un grad ridicat de inflamabilitate, prin urmare, atunci când lucrați cu acesta, este necesar să respectați măsurile de siguranță pentru lucrul cu lichide inflamabile. Vaporii de benzen sunt de mare pericol, deoarece pot forma amestecuri explozive cu aerul. În prezent, utilizarea benzenului ca solvent organic este foarte limitată datorită toxicității și efectelor cancerigene ale vaporilor și impact negativ pe piele. Lucrul cu benzen în laboratoare prevede, de asemenea, limitarea acestuia (strict reglementată). Se recomandă utilizarea benzenului în experimente numai în volume mici (nu mai mult de 50 ml), munca trebuie efectuată exclusiv în mănuși din fluoroelastomer (latexul se dizolvă și se umflă atunci când este expus la benzen).
- depozitați lângă surse de căldură, flăcări deschise, oxidanți puternici, Produse alimentare, și așa mai departe,
- lăsa în formă deschisă recipient care conține benzen, fum,
- folosiți recipiente cu benzen pentru uz alimentar, spălarea mâinilor, vase,
- lucrați într-o încăpere închisă, slab ventilată, cu o temperatură a aerului mai mare de 30 ° C,
- utilizare volum mare substanțe ca solvent
- lucrați fără echipament de protecție pentru pielea mâinilor, a ochilor și a organelor respiratorii.
Ecologie
Benzenul este o substanță nesigură pentru mediu, un toxic de origine antropică. Principalele surse de benzen care intră în mediu inconjurator co canalizare sau emisiile în aer sunt industria petrochimică și a cocsului, producția de combustibil și transportul. Din rezervoare, benzenul se volatilizează ușor, este capabil să se transforme din sol în plante, ceea ce reprezintă o amenințare serioasă pentru ecosisteme.
Benzenul are proprietatea cumulării, datorită lipofilității sale, este capabil să se depună în celulele țesutului adipos al animalelor, otrăvindu-le astfel.
PRTSVSH (F) FGBOU VPO
Departamentul „Securitate la incendiu”
Test
la disciplina „Teoria arderii și exploziilor”
Sarcina numărul 1
Determinați cantitățile teoretice specifice și volumul de aer necesar pentru arderea completă a vaporilor de benzen. Conditiile in care se afla aerul se caracterizeaza prin temperatura Tv si presiunea Pv, iar vaporii de benzen - temperatura Tg si presiunea Pg. Exprimați rezultatele calculului în următoarele unități: ; ;;;
Date inițiale (N - numărul grupului, n - numărul conform listei de elevi:
TV=300+(-1) N *2*N-(-1) n *0,2*n= 277,6 K
Pv \u003d?10 3 \u003d 95900 Pa;
Тg=300a(a1) N52aNj(a1) n50,2n= 321,6 K;
Pr \u003d? 10 3 \u003d 79400 Pa.
С6Н6+7.5О2+7.5?3.76N2=6CO2+3pO+7.5?3.76N2+Qp (1),
unde Qp este căldura unei reacții chimice. Din această ecuație, este posibil să se determine coeficienții stoichiometrici ai benzenului și oxigenului molecular: Vg = 1, V0 = 7,5
2. Cantitatea teoretică specifică de aer - numărul de kilomoli de aer care sunt necesari pentru arderea completă a unui kilomol de benzen este calculat prin formula:
unde 4,76 este cantitatea de aer care conține o unitate de oxigen, \u003d este raportul dintre coeficienții stoichiometrici ai oxigenului molecular (Vo) și benzenului (Vg)
Înlocuind în (d) valorile lui Vo și Vg, obținem:
3. Volumul de aer necesar pentru arderea completă a unui kilomol de benzen se determină după cum urmează:
unde este volumul unui kilomol de aer la temperatura Tv și presiunea Pv. Valoarea se calculează folosind formula
unde 22,4 este volumul molar al gazului în condiții normale, Po = 101325 Pa este presiunea normală, To = 273 K este temperatura normală.
Înlocuind Tv, To, Pv, Po în (5), obținem
Volumul de aer teoretic specific se calculează prin formula (4):
4. Volumul de aer necesar pentru arderea completă a unui volum unitar de combustibil gazos se determină după cum urmează:
unde este volumul unui kilomol de combustibil - vapori de benzen la temperatura Tg si presiunea Pg. Dat fiind
și înlocuind (8) și (5) în (7), obținem următoarea expresie pentru volumul de aer teoretic specific:
Calculăm valoarea acestui parametru al procesului de ardere:
Volumul de aer necesar pentru arderea completă a unui kilogram de benzen se determină după cum urmează:
unde - masa molară a combustibilului este masa unui kilomol de benzen, exprimată în kilograme. Masa molară a benzenului este numeric egală cu greutatea sa moleculară se găsește prin formula:
Ac?nc + An?nn, UiAi?ni (11)
unde Ac și An sunt greutățile atomice ale carbonului și hidrogenului, nc și nn sunt numărul de atomi de carbon din molecula de benzen. Înlocuind valorile Ac = 12, nc = 6, An = 1, nn = 6, obținem:
Găsim volumul teoretic specific al aerului prin înlocuirea valorilor lui n în și în formula (10):
Rezultatul calculului:
Sarcina numărul 2
Determinați cantitatea teoretică specifică, volumul și compoziția produselor de ardere a benzenului, dacă se cunosc coeficientul de exces de aer c, temperatura Tp și presiunea Pp a produselor de ardere, temperatura Tg și presiunea Pg a vaporilor de benzen. Exprimați rezultatele calculului în fracții molare (în procente) și în următoarele unități: ; ;;
Date inițiale:
c=1,5+(a1) N-0,1-N-(a1) n-0,01?n = 0,2;
Rp \u003d? 10 3 \u003d 68400 Pa;
Tp = 1600a(a1) N520aN5(a1) n52an = 1816 K;
Тg=273a(a1) N52aN+(a1) n50,2n = 295,4 K;
Rg \u003d? 10 3 \u003d 111600 Pa;
soluție (N=11, n=2).
1. Scriem ecuația stoechiometrică pentru reacția arderii benzenului în aer:
C 6 H 6 +7.5O 2 +7.5? 3.76N 2 \u003d 6CO 2 + 3H 2 O + 7.5? 3.76N 2 + Qp, (1)
unde Qp este căldura unei reacții chimice. Din această ecuație, determinăm următorii coeficienți stoichiometrici:
V CO2 \u003d 6, V pO \u003d 3, V C6H6 \u003d 1, V O2 \u003d 7,5, V N2 \u003d 7,5? 3,76
2. Determinați cantitatea estimată de produse de ardere a unui kilomol de combustibil:
Înlocuind în (2) valorile coeficienților stoichiometrici ai produselor de ardere și combustibilului, se obține:
3. Cantitatea teoretică specifică de aer - numărul de kilomoli de aer necesar pentru arderea completă a unui kilomol de combustibil, determinăm folosind formula:
Unde 4,76 este cantitatea de aer care conține o unitate de oxigen,
Raportul coeficienților stoichiometrici ai oxigenului molecular și benzenului.
Înlocuind în (4) valorile V O2 =7,5 și V C6H6 =1 , obținem:
4. Excesul de aer care cade pe 1 Kmol de combustibil este determinat de expresia:
aer de ardere cu abur de benzen
Înlocuind în această expresie valorile
37,7(0,2-1)=30,16(7)
5. Cantitatea totală de produse de ardere pe unitatea de cantitate de substanță combustibilă este determinată de suma:
După înlocuirea valorilor și obținem:
6. Fracțiile molare ale produselor de ardere, exprimate în procente, se determină după cum urmează:
În formulele (9) pentru fracțiile molare de azot și oxigen din produsele de ardere, 0,79 și 0,21 sunt fracțiile molare ale acestor substanțe din aer, al căror exces duce la creșterea proporției de azot și la apariția oxigenului. în produsele de ardere.
7. Pentru a determina volumele specifice și produsele de ardere, este necesar să se calculeze volumul lor molar - volumul unui kilomol de gaz în condițiile în care se află produsele:
unde 22,4 este volumul unui kilomol de gaz în condiții normale, T 0 \u003d 273K - temperatura normală, Po \u003d 101325 Pa - presiune normală.
Înlocuind în (10) valorile, Po, To, obținem:
Volumul de produse care se formează în timpul arderii unui kilogram de combustibil, excluzând excesul de aer, se calculează după cum urmează:
unde - masa molară a combustibilului este masa unui kilomol de benzen, exprimată în kilograme. Masa molară a benzenului se găsește după formula:
unde Ac și An sunt greutățile atomice ale carbonului (12) și hidrogenului (1), n c și n n sunt numerele de atomi de carbon (6) și hidrogen (6) din moleculele de benzen (C 6 H 6).
Înlocuind valorile, și în (12) obținem
Volumul în exces de aer per 1 kilogram de combustibil se determină după cum urmează:
unde este volumul unui kilomol de aer în exces, care face parte din produsele de ardere. Deoarece temperatura și presiunea aerului în exces corespund temperaturii și presiunii produselor de ardere, atunci \u003d \u003d 220,7.
Înlocuind această valoare, precum și în (14), obținem:
Pentru a calcula volumul specific al produselor de ardere completă a combustibilului, presupunem că vaporii de benzen au o temperatură Tg la presiune:
unde este volumul unui kilomol de vapori de benzen la temperatura Tg și presiunea Pg. Volumul molar de combustibil se calculează cu formula:
Înlocuind valoarea obținută și astfel de valori în (17), obținem:
Volumul în exces de aer pe metru cub de vapori de benzen se determină după cum urmează:
Înlocuirea în (20) valori \u003d 30,16 , \u003d și
dă următorul rezultat:
Volumul specific total al produselor de ardere, ținând cont de excesul de aer, este determinat de sumă
Rezultatul calculului:
X CO2 \u003d%; X H2O \u003d 4,4%; X N2 =%; X O2 \u003d 11,7%
Documente similare
Calculul coeficientului de combustibilitate al nitrobenzenului C6H5NO2 și al disulfurei de carbon CS2. Ecuația pentru reacția de ardere a acetatului de propil în aer. Calculul volumului de aer și produse de ardere în timpul arderii gazelor combustibile. Determinarea punctului de aprindere al toluenului după formula lui V. Blinov.
test, adaugat 04.08.2017
Calculul volumului de aer și al produselor de ardere formate în timpul arderii unei substanțe. Ecuația pentru reacția de ardere a etilenglicolului în aer. Arderea unui amestec de gaze combustibile. Calculul temperaturii de ardere adiabatică pentru un amestec stoichiometric. arderea propanolului.
test, adaugat 17.10.2012
Tipul de ardere și principalii săi parametri. Conversia chimică a combustibilului și a oxidantului în produse de ardere. Ecuații de material și echilibru termic al reacției de ardere. Influența coeficientului de aer în exces asupra compoziției produselor de ardere și a temperaturii de ardere.
test, adaugat 17.01.2013
Determinarea volumului de aer necesar pentru arderea completă a unei unități de masă a unei substanțe combustibile. Compoziția produselor de ardere a unei unități de masă a unei substanțe combustibile. Limitele de propagare a flăcării a amestecurilor de gaz, abur, praf-aer. Presiune de descompunere explozivă.
lucrare de termen, adăugată 23.12.2013
Elaborarea măsurilor de prevenire a apariției incendiilor și exploziilor, evaluarea condițiilor de desfășurare și stingere a acestora. Conceptul de burnout rate, metoda definirii sale. Procedura de compilare a ecuației reacției de ardere. Calculul volumului de aer necesar pentru aprindere.
lucrare de termen, adăugată 07.10.2014
Determinarea compoziției produselor de ardere completă a gazului. Calculul temperaturii de ardere adiabatică a unui amestec de gaze la volum constant și presiune constantă. Constantele de reacție cinetică de autoaprindere a gazelor naturale. Limita de aprindere a amestecului de gaze.
lucrare de termen, adăugată 19.02.2014
Caracterizarea metodelor industriale de alchilare a benzenului cu propilenă. Principii de alchilare a benzenului cu olefine în tehnologia chimică. Probleme de proiectare a instalaţiilor tehnologice pentru alchilarea benzenului. Descrierea tehnologiei procesului de producție.
teză, adăugată 15.11.2010
Arderea este un proces puternic de oxidare. Tipuri de ardere: mocnit și ardere cu flacără. Explozia ca caz special de ardere. Proprietățile electrice ale flăcării. Varietate de produse de ardere ca urmare a arderii incomplete a combustibilului. Filtrarea fumului prin apă.
lucrare stiintifica, adaugata 29.07.2009
Determinarea volumului de aer necesar pentru arderea completă a unei cantități date de propan. Calculul modificării entalpiei, entropiei și energiei Gibbs, folosind consecințele legii lui Hess. Determinarea echivalenților de masă molară ai agentului oxidant și agentului reducător.
test, adaugat 02.08.2012
Metode de determinare a consumului de ulei absorbant, concentrația de benzen în uleiul absorbant care părăsește absorbantul. Calculul diametrului și înălțimii absorbantului ambalat. Determinarea suprafeței de încălzire necesare în cubul coloanei și a consumului de abur de încălzire.
HC aromatice (arene) sunt hidrocarburi ale căror molecule conțin unul sau mai multe inele benzenice.
Exemple de hidrocarburi aromatice:

Arene de rând cu benzen (arene monociclice)
Formula generala:CnH2n-6, n≥6
Cel mai simplu reprezentant al hidrocarburilor aromatice este benzenul, formula sa empirică este C 6 H 6 .
Structura electronică a moleculei de benzen
Formula generală a arenelor monociclice C n H 2 n -6 arată că acestea sunt compuși nesaturați.
În 1856, chimistul german A.F. Kekule a propus o formulă ciclică pentru benzen cu legături conjugate (legături simple și duble alternative) - ciclohexatrien-1,3,5: 
Această structură a moleculei de benzen nu a explicat multe dintre proprietățile benzenului:
- pentru benzen, reacțiile de substituție sunt caracteristice, și nu reacțiile de adiție caracteristice compușilor nesaturați. Reacțiile de adaos sunt posibile, dar sunt mai dificile decât pentru;
- benzenul nu intră în reacții care sunt reacții calitative la hidrocarburi nesaturate (cu apă cu brom și o soluție de KMnO 4).
Studiile de difracție a electronilor efectuate ulterior au arătat că toate legăturile dintre atomii de carbon dintr-o moleculă de benzen au aceeași lungime de 0,140 nm (valoarea medie dintre lungimea unui simplu Conexiuni C-C 0,154 nm și C=C dublă legătură 0,134 nm). Unghiul dintre legăturile la fiecare atom de carbon este de 120°. Molecula este un hexagon plat obișnuit.
Teoria modernă pentru a explica structura moleculei C 6 H 6 folosește conceptul de hibridizare a orbitalilor atomici.
Atomii de carbon din benzen sunt într-o stare de hibridizare sp 2. Fiecare atom „C” formează trei legături σ (două cu atomi de carbon și una cu un atom de hidrogen). Toate legăturile σ sunt în același plan:
Fiecare atom de carbon are un electron p, care nu participă la hibridizare. Orbitalii p nehibridați ai atomilor de carbon se află într-un plan perpendicular pe planul legăturilor σ. Fiecare p-nor se suprapune cu doi p-nori vecini, iar ca urmare se formează un singur sistem π conjugat (remintiți-vă efectul conjugării electronilor p în molecula de 1,3-butadienă, discutat în subiectul „Hidrocarburi diene ”):
Se numește combinația de șase legături σ cu un singur sistem π legătură aromatică.
Se numește un inel de șase atomi de carbon legați printr-o legătură aromatică inel de benzen, sau nucleul benzenic.
În conformitate cu ideile moderne despre structura electronică a benzenului, molecula C 6 H 6 este descrisă după cum urmează:

Proprietățile fizice ale benzenului
Benzenul în condiții normale este un lichid incolor; t o pl = 5,5 o C; t o kip. = 80 aproximativ C; are un miros caracteristic; nu se amesteca cu apa solvent bun, foarte toxic.
Proprietățile chimice ale benzenului
Legătura aromatică determină proprietățile chimice ale benzenului și ale altor hidrocarburi aromatice.
Sistemul de electroni 6π este mai stabil decât legăturile π convenționale cu doi electroni. Prin urmare, reacțiile de adiție sunt mai puțin tipice pentru hidrocarburile aromatice decât pentru hidrocarburile nesaturate. Cele mai tipice pentru arene sunt reacțiile de substituție.
eu. Reacții de substituție
1.Halogenare

2. Nitrare
Reacția se efectuează cu un amestec de și acizi (amestec de nitrare): 
3. Sulfonare

4. Alchilare (înlocuirea atomului "H" cu o grupare alchil) - Reacții Friedel-Crafts, se formează omologi ai benzenului:

În loc de haloalcani, pot fi utilizate alchene (în prezența unui catalizator - AlCl 3 sau acid anorganic):

II. Reacții de adaos
1. Hidrogenarea

2. Adaos de clor

III.Reacții de oxidare
1. Arderea
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O
2. Oxidare incompletă (KMnO 4 sau K 2 Cr 2 O 7 în mediu acid). Inelul benzenic este rezistent la agenții oxidanți. Reacția nu are loc.
Obținerea de benzen
In industrie:
1) prelucrarea petrolului și a cărbunelui;
2) dehidrogenarea ciclohexanului:

3) dehidrociclizarea (aromatizarea) hexanului:

In laborator:
Fuziunea sărurilor acidului benzoic cu:

Izomeria și nomenclatura omologilor benzenului
Orice omolog de benzen are o catenă laterală, de exemplu. radicali alchil atașați la ciclul benzenic. Primul omolog al benzenului este un nucleu benzen legat de un radical metil: 
Toluenul nu are izomeri, deoarece toate pozițiile din inelul benzenic sunt echivalente.
Pentru omologii ulterioare ai benzenului, este posibil un tip de izomerie - izomeria lanțului lateral, care poate fi de două tipuri:
1) izomeria numărului și structurii substituenților;
2) izomeria poziţiei substituenţilor.



Proprietățile fizice ale toluenului
Toluen- un lichid incolor cu miros caracteristic, insolubil în apă, solubil în solvenți organici. Toluenul este mai puțin toxic decât benzenul.
Proprietățile chimice ale toluenului
eu. Reacții de substituție
1. Reacții care implică inelul benzenic
Metilbenzenul intră în toate reacțiile de substituție în care este implicat benzenul și, în același timp, prezintă o reactivitate mai mare, reacțiile decurg cu o viteză mai rapidă.
Radicalul metil conținut în molecula de toluen este un substituent al genului, prin urmare, în urma reacțiilor de substituție în nucleul benzenic, se obțin orto- și para-derivați ai toluenului sau, cu un exces de reactiv, tri-derivați. a formulei generale:

a) halogenare


Cu o clorurare suplimentară, se pot obține diclorometilbenzen și triclorometilbenzen:

II. Reacții de adaos
hidrogenare

III.Reacții de oxidare
1. Arderea
C 6 H 5 CH 3 + 9O 2 → 7CO 2 + 4H 2 O
2. Oxidare incompletă
Spre deosebire de benzen, omologii săi sunt oxidați de unii agenți oxidanți; în acest caz, catena laterală suferă oxidare, în cazul toluenului, gruparea metil. Agenții de oxidare ușoară, cum ar fi MnO 2, îl oxidează la o grupare aldehidă, agenții de oxidare mai puternici (KMnO 4) provoacă oxidarea ulterioară la un acid: 
Orice omolog al benzenului cu o catenă laterală este oxidat de un agent oxidant puternic, cum ar fi KMnO4, la acid benzoic, de exemplu. există o ruptură în lanțul lateral cu oxidarea părții sale scindate la CO2; De exemplu: 
În prezența mai multor lanțuri laterale, fiecare dintre ele este oxidat la o grupare carboxil și, ca rezultat, se formează acizi polibazici, de exemplu:

Obținerea de toluen:
In industrie:
1) prelucrarea petrolului și a cărbunelui;
2) dehidrogenarea metilciclohexanului:

3) dehidrociclizarea heptanului:
In laborator:
1) alchilare Friedel-Crafts;
2) Reacția Wurtz-Fittig(reacția sodiului cu un amestec de halobenzen și haloalcan).
Proprietăți fizice
Benzenul și omologii săi cei mai apropiați sunt lichide incolore cu un miros specific. Hidrocarburile aromatice sunt mai ușoare decât apa și nu se dizolvă în ea, cu toate acestea, se dizolvă ușor în solvenți organici - alcool, eter, acetonă.
Benzenul și omologii săi sunt ei înșiși solvenți buni pentru mulți materie organică. Toate arenele ard cu o flacără fumurie datorită conținutului ridicat de carbon din moleculele lor.
Proprietățile fizice ale unor arene sunt prezentate în tabel.
Masa. Proprietățile fizice ale unor arene
|
Nume |
Formulă |
t°.pl., |
t°.bp., |
|
Benzen |
C6H6 |
5,5 |
80,1 |
|
Toluen (metilbenzen) |
C6H5CH3 |
95,0 |
110,6 |
|
Etilbenzen |
C6H5C2H5 |
95,0 |
136,2 |
|
Xilen (dimetilbenzen) |
C6H4(CH3)2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
pereche- |
13,26 |
138,35 |
|
|
Propilbenzen |
C6H5(CH2)2CH3 |
99,0 |
159,20 |
|
Cumen (izopropilbenzen) |
C6H5CH(CH3)2 |
96,0 |
152,39 |
|
Stiren (vinilbenzen) |
C 6 H 5 CH \u003d CH 2 |
30,6 |
145,2 |
Benzen - cu punct de fierbere scăzut ( tkip= 80,1°C), lichid incolor, insolubil în apă
Atenţie! Benzen - otravă, acționează asupra rinichilor, modifică formula sângelui (cu expunere prelungită), poate perturba structura cromozomilor.
Majoritatea hidrocarburilor aromatice pun viața în pericol și sunt toxice.
Obținerea de arene (benzen și omologii săi)
In laborator
1. Fuziunea sărurilor acidului benzoic cu alcalii solide
C6H5-COONa + NaOH t → C6H6 + Na2CO3
benzoat de sodiu
2. Reacția Wurtz-Fitting: (aici G este halogen)
De la 6H 5 -G+2N / A + R-G →C 6 H 5 - R + 2 N / AG
CU 6 H5-Cl + 2Na + CH3-Cl → C6H5-CH3 + 2NaCl
În industrie
- izolat din petrol și cărbune prin distilare fracționată, reformare;
- din gudronul de cărbune și gazul cuptorului de cocs
1. Dehidrociclizarea alcanilor cu mai mult de 6 atomi de carbon:
C6H14 t , kat→C6H6 + 4H2
2. Trimerizarea acetilenei(doar pentru benzen) – R. Zelinsky:
3C 2 H2 600°C, Act. cărbune→C6H6
3. Dehidrogenare ciclohexan și omologii săi:
Academicianul sovietic Nikolai Dmitrievich Zelinsky a stabilit că benzenul se formează din ciclohexan (dehidrogenarea cicloalcanilor
C6H12 t, pisica→C6H6 + 3H2

C6H11-CH3 t , kat→C6H5-CH3 + 3H2
metilciclohexanetoluen
4. Alchilarea benzenului(obținerea de omologi ai benzenului) – r Friedel-Crafts.
C6H6 + C2H5-CI t, ACI3→C6H5-C2H5 + HCI
cloretan etilbenzen

Proprietățile chimice ale arenelor
eu. REACȚII DE OXIDARE
1. Combustie (flacără fumurie):
2C6H6 + 15O2 t→12CO2 + 6H2O + Q
2. Benzenul în condiţii normale nu decolorează apa cu brom şi soluție de apă permanganat de potasiu
3. Omologii benzenului sunt oxidați de permanganat de potasiu (permanganat de potasiu decolorat):
A) într-un mediu acid la acidul benzoic
Sub acțiunea permanganatului de potasiu și a altor oxidanți puternici asupra omologilor benzenului, lanțurile laterale sunt oxidate. Indiferent cât de complexă este lanțul substituentului, acesta este distrus, cu excepția atomului de carbon a, care este oxidat într-o grupare carboxil.
Omologii benzenului cu un lanț lateral dau acid benzoic:
Omologuri care conțin două lanțuri laterale dau acizi dibazici:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
Simplificat :
C6H5-CH3+3O KMnO4→C6H5COOH + H2O
B) în săruri neutre și ușor alcaline ale acidului benzoic
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO2 + H2O
II. REACȚII SUPLIMENTARE (mai greu decât alchenele)
1. Halogenare
C6H6 + 3CI2 h ν → C6H6CI6 (hexaclorociclohexan - hexacloran)
2. Hidrogenarea
C6H6 + 3H2 t , PtsauNi→C6H12 (ciclohexan)
3. Polimerizare
III. REACȚII DE SUBSTITUȚIE – mecanism ionic (mai usor decat alcanii)
1. Halogenare -
A ) benzen
C6H6 + CI2 AlCl 3 → C6H5-CI + HCI (clorobenzen)
C6H6 + 6CI2 t,AlCl3→C6CI6 + 6HCI( hexaclorbenzen)
C6H6 + Br2 t,FeCl3→ C6H5-Br + HBr( bromobenzen)
b) omologi de benzen la iradiere sau încălzire
În ceea ce privește proprietățile chimice, radicalii alchil sunt similari cu alcanii. Atomii de hidrogen din ei sunt înlocuiți cu halogeni printr-un mecanism de radicali liberi. Prin urmare, în absența unui catalizator, încălzirea sau iradierea UV duce la o reacție de substituție radicală în lanțul lateral. Influența inelului benzenic asupra substituenților alchil duce la faptul că atomul de hidrogen este întotdeauna înlocuit la atomul de carbon legat direct de inelul benzenic (a-atomul de carbon).
1) C6H5-CH3 + CI2 h ν → C6H5-CH2-CI + HCI
c) omologi de benzen în prezenţa unui catalizator
C6H5-CH3 + CI2 AlCl 3 → (amestec de orta, pereche de derivați) +HCl
2. Nitrare (cu acid azotic)
C6H6 + HO-NO2 t, H2S04→C6H5-NO2 + H2O
nitrobenzen - miros migdale!
C6H5-CH3 + 3HO-N02 t, H2S04→ CU H3-C6H2 (N02)3 + 3H202,4,6-trinitrotoluen (tol, trotil)
Utilizarea benzenului și a omologilor săi
Benzen C6H6 este un solvent bun. Benzenul ca aditiv îmbunătățește calitatea combustibilului pentru motor. Servește ca materie primă pentru producerea multor compuși organici aromatici - nitrobenzen C 6 H 5 NO 2 (solvent, se obține anilină din acesta), clorbenzen C 6 H 5 Cl, fenol C 6 H 5 OH, stiren etc.
Toluen C 6 H 5 -CH 3 - un solvent utilizat la fabricarea coloranților, medicamentelor și explozivilor (trotil (tol) sau 2,4,6-trinitrotoluen TNT).
Xilen C6H4(CH3)2. Xilenul tehnic este un amestec de trei izomeri ( orto-, meta- Și pereche-xilene) - este folosit ca solvent și produs inițial pentru sinteza multor compuși organici.
Izopropilbenzen C6H5-CH (CH3)2 serveşte la obţinerea fenolului şi acetonei.
Derivați de clor ai benzenului folosit pentru protectia plantelor. Astfel, produsul de substituție a atomilor de H din benzen cu atomi de clor este hexaclorbenzenul C 6 Cl 6 - un fungicid; se folosește pentru ameliorarea semințelor uscate de grâu și secară împotriva smoală tare. Produsul adăugării clorului la benzen este hexaclorciclohexan (hexacloran) C 6 H 6 Cl 6 - un insecticid; este folosit pentru combaterea insectelor dăunătoare. Aceste substanțe se referă la pesticide - mijloace chimice de combatere a microorganismelor, plantelor și animalelor.
Stiren C 6 H 5 - CH \u003d CH 2 polimerizează foarte ușor, formând polistiren și copolimerizează cu cauciucuri butadienă - stiren-butadienă.
EXPERIENȚE VIDEO
Primul grup de reacții este reacțiile de substituție. Am spus că arenele nu au legături multiple în structura moleculară, dar conțin un sistem conjugat de șase electroni, care este foarte stabil și oferă o putere suplimentară inelului benzenic. Prin urmare, în reacții chimiceînlocuirea atomilor de hidrogen are loc mai întâi, și nu distrugerea inelului benzenic.
Am întâlnit deja reacții de substituție când vorbim despre alcani, dar pentru ei aceste reacții au decurs după un mecanism radical, iar pentru arene mecanismul ionic al reacțiilor de substituție este caracteristic.
Primul proprietăți chimice halogenare. Înlocuirea unui atom de hidrogen cu un atom de halogen clor sau brom.
Reacția are loc atunci când este încălzită și întotdeauna cu participarea unui catalizator. În cazul clorului, poate fi clorură de aluminiu sau clorură de fier trei. Catalizatorul polarizează molecula de halogen, rezultând ruperea legăturii heterolitice și se obțin ioni.
Ionul de clorură încărcat pozitiv reacţionează cu benzenul.
Dacă reacția are loc cu brom, atunci bromura de fier trei sau bromura de aluminiu acționează ca catalizator.

Este important de menționat că reacția are loc cu bromul molecular și nu cu apa cu brom. Benzenul nu reacționează cu apa cu brom.
Halogenarea omologilor benzenului are propriile sale caracteristici. În molecula de toluen, gruparea metil facilitează substituția în inel, reactivitatea crește, iar reacția se desfășoară în condiții mai blânde, adică deja la temperatura camerei.

Este important de menționat că substituția are loc întotdeauna în pozițiile orto și para, astfel încât se obține un amestec de izomeri.
Al doilea proprietăți nitrarea benzenului, introducerea unei grupări nitro în inelul benzenic.

Se formează un lichid greu gălbui cu miros de migdale amare nitrobenzen, astfel încât reacția poate fi calitativă pentru benzen. Pentru nitrare se folosește un amestec de nitrare de acizi azotic și sulfuric concentrați. Reacția se realizează prin încălzire.
Permiteți-mi să vă reamintesc că pentru nitrarea alcanilor în reacția Konovalov, diluați Acid azotic fără adaos de sulfuric.
În nitrarea toluenului, precum și în halogenare, se formează un amestec de orto- și para-izomeri.

Al treilea proprietatea de alchilare a benzenului cu haloalcani.
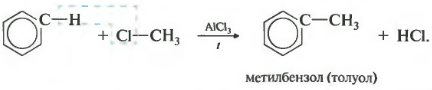
Această reacție permite introducerea unui radical de hidrocarbură în ciclul benzenic și poate fi considerată o metodă de obținere a omologilor benzenului. Clorura de aluminiu este folosită ca catalizator, care favorizează descompunerea moleculei de haloalcan în ioni. Are nevoie si de incalzire.
Al patrulea proprietatea de alchilare a benzenului cu alchene.

În acest fel, de exemplu, se poate obţine cumen sau etilbenzen. Catalizator clorură de aluminiu.
2. Reacții de adiție la benzen
Al doilea grup de reacții este reacțiile de adiție. Am spus că aceste reacții nu sunt caracteristice, dar sunt posibile în condiții destul de dure cu distrugerea norului de electroni pi și formarea de legături șase sigma.
a cincea proprietate în lista generala hidrogenare, adăugare de hidrogen.
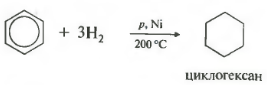
Temperatura, presiunea, catalizatorul nichel sau platina. Toluenul este capabil să reacționeze în același mod.
şaselea clorinare de proprietate. Vă rugăm să rețineți că vorbim în mod specific despre interacțiunea cu clorul, deoarece bromul nu intră în această reacție.

Reacția are loc sub iradiere ultravioletă dură. Se formează hexaclorociclohexan, un alt nume pentru hexacloran, un solid.
Este important să rețineți că pentru benzen nu este posibil reacții de adiție de halogenuri de hidrogen (hidrohalogenare) și adăugare de apă (hidratare).
3. Înlocuirea în lanțul lateral a omologilor benzenului
Al treilea grup de reacții se referă numai la omologii benzenului - aceasta este o substituție în lanțul lateral.
al șaptelea proprietate în lista generală halogenare la atomul de carbon alfa din lanțul lateral.

Reacția are loc atunci când este încălzită sau iradiată și întotdeauna numai la carbonul alfa. Pe măsură ce halogenarea continuă, al doilea atom de halogen va reveni la poziția alfa.
4. Oxidarea omologilor benzenului
Al patrulea grup de reacții este oxidarea.
Inelul de benzen este prea puternic, deci benzen nu se oxideaza permanganatul de potasiu nu își decolorează soluția. Acest lucru este foarte important de reținut.
Pe de altă parte, omologii benzenului sunt oxidați cu o soluție acidulată de permanganat de potasiu atunci când sunt încălziți. Și aceasta este a opta proprietate chimică.
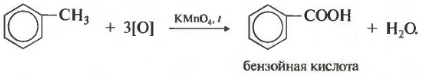
Se dovedește acid benzoic. Se observă decolorarea soluției. În acest caz, indiferent cât de lungă este lanțul de carbon al substituentului, acesta se rupe întotdeauna după primul atom de carbon și atomul alfa este oxidat la o grupare carboxil cu formarea acidului benzoic. Restul moleculei este oxidat la acidul corespunzător sau, dacă este doar un atom de carbon, la dioxid de carbon.
Dacă omologul benzenului are mai mult de un substituent de hidrocarbură pe inelul aromatic, atunci oxidarea are loc după aceleași reguli - carbonul în poziția alfa este oxidat.

În acest exemplu, se obține un acid aromatic dibazic, care se numește acid ftalic.
In mod deosebit, remarc oxidarea cumenului, izopropilbenzenului, cu oxigenul atmosferic in prezenta acidului sulfuric.

Aceasta este așa-numita metodă cumenă pentru producerea fenolului. De regulă, trebuie să se ocupe de această reacție în chestiuni legate de producerea de fenol. Aceasta este calea industrială.
nouălea ardere de proprietate, oxidare completă cu oxigen. Benzenul și omologii săi arde până la dioxid de carbon și apă.
Să scriem ecuația pentru arderea benzenului într-o formă generală.
Conform legii conservării masei, ar trebui să existe atâția atomi în stânga câte atomi sunt în dreapta. Pentru că, până la urmă, în reacțiile chimice, atomii nu merg nicăieri, dar ordinea legăturilor dintre ei pur și simplu se schimbă. Deci vor exista tot atâtea molecule de dioxid de carbon câte atomi de carbon există într-o moleculă de arenă, deoarece molecula conține un atom de carbon. Adică n molecule de CO2. Vor fi jumătate din câte molecule de apă decât atomii de hidrogen, adică (2n-6) / 2, ceea ce înseamnă n-3.
Există același număr de atomi de oxigen în stânga și în dreapta. În dreapta, sunt 2n din dioxid de carbon, deoarece sunt doi atomi de oxigen în fiecare moleculă, plus n-3 din apă, pentru un total de 3n-3. În stânga, există același număr de atomi de oxigen 3n-3, ceea ce înseamnă că sunt de două ori mai puține molecule, deoarece molecula conține doi atomi. Adică (3n-3)/2 molecule de oxigen.
Astfel, am compilat ecuația pentru arderea omologilor benzenului într-o formă generală.





